La histamina, amina biógena, es un mediador indispensable en la inflamación, la anafilaxia y la secreción de ácido gástrico; además, interviene en la transmisión nerviosa. Los conocimientos de las acciones fisiológicas y fisiopatológicas de la histamina se han ampliado gracias a la creación de antagonistas de receptores específicos de subtipo, y la clonación de cuatro receptores de la histamina. Los antagonistas competitivos de los receptores H1 poseen acciones diversas y se utilizan para tratar alergias, urticaria, reacciones anafilácticas, náuseas, cinetosis, insomnio y algunos síntomas del asma. Los antagonistas del receptor H2 son eficaces para reducir la secreción de ácido gástrico. El péptido bradicinina tiene efectos en el aparato cardiovascular similares a los de la histamina, y además desempeña acciones extraordinarias en la inflamación y la nocicepción.
HISTAMINA
Historia. La historia de la histamina (aminoetilimidazol β) guarda semejanzas con la de la acetilcolina (ACh). Ambas fueron sintetizadas químicamente antes de que se conociera su importancia biológica; fueron detectadas por primera vez como estimulantes uterinos y se aislaron de los extractos del cornezuelo de centeno, se comprobó que eran contaminantes que aparecían gracias a la acción bacteriana (Dale, 1953).
Dale y Laidlaw sometieron a la histamina a un estudio farmacológico intensivo (Dale, 1953) y descubrieron que estimulaba muy diversos músculos de fibra lisa y que poseía una intensa acción vasodepresora. Como dato importante, observaron que cuando se inyectaba una proteína normalmente inerte a un animal sensibilizado, las respuestas inmediatas se asemejaban mucho a las de la intoxicación por histamina. Las observaciones comentadas se realizaron muchos años antes de que se detectara que la histamina endógena contribuye a las reacciones de hipersensibilidad inmediata y a las respuestas ante la lesión celular. Best y colaboradores (1927) aislaron histamina de muestras recién obtenidas de hígado y pulmón y así definieron que era constituyente natural de los tejidos de mamífero, con lo cual acuñaron el nombre de histamina con base en el término griego histos, tejido. La presencia de histamina en los extractos hísticos retrasó la aceptación del descubrimiento de algunas hormonas peptídicas y proteínicas (como la gastrina) hasta que se contó con técnicas para separar las sustancias naturales (Grossman, 1966).
Lewis y colaboradores (Lewis, 1927) propusieron que las células de la piel bajo la acción de estímulos lesivos liberaban una sustancia con las propiedades de la histamina (“sustancia H”), incluida la reacción de antígeno/anticuerpo. Sabemos ahora que la histamina endógena interviene en la respuesta alérgica inmediata y que es un regulador decisivo de la secreción de ácido en el estómago. En fecha más reciente se ha detectado la acción de la histamina como modulador de la liberación de neurotransmisores en el sistema nervioso central y el periférico.

Las sospechas iniciales de que la histamina actuaba a través de varios receptores nació gracias a la identificación de cuatro clases de ellos llamados H1 (Ash y Schild, 1966); H2 (Black et al., 1972), H3 (Arrang et al., 1987) y H4 (Leurs et al., 2009). Los receptores H1 son bloqueados de manera selectiva por los “antihistamínicos” clásicos. Se conoce en forma colectiva a la segunda generación de antagonistas H1 como antihistamínicos no sedantes.
El término tercera generación se ha aplicado a algunos antihistamínicos más recientes, como los metabolitos activos de los antihistamínicos de la primera o la segunda generación que no se metabolizan más (p. ej., la cetirizina derivada de la hidroxicina o la fexofenadina obtenida de la terfenadina) o a antihistamínicos que poseen más efectos terapéuticos. Sin embargo, el Consensus Group on New-Generation Antihistamines, concluyó que ninguno de los antihistamínicos actuales se puede clasificar como un fármaco de tercera generación real, definido por la falta de cardiotoxicidad, interacciones medicamentosas y efectos en el SNC, o con posibles efectos beneficiosos adicionales (p. ej., antiinflamatorio) (Holgate et al., 2003). El descubrimiento de los antagonistas de H2 y su capacidad de inhibir la secreción gástrica ha contribuido enormemente a acrecentar el interés por la histamina en medicina biológica y clínica. Los receptores H3 se identificaron como autorreceptores presinápticos en las neuronas que contienen histamina y que median la inhibición por retroalimentación de la liberación y síntesis de histamina. La obtención de los agonistas selectivos y antagonistas del receptor H3 ha ampliado los conocimientos de la importancia de ese tipo de receptores in vivo en las neuronas histaminérgicas. Ninguno de los agonistas o antagonistas de H3 ha terminado por ser un agente terapéutico útil (Sanderet al., 2008). El receptor H4 es muy similar al receptor H3, pero se expresa en células de líneas hematopoyéticas; el hecho de contar con antagonistas específicos de H4 con propiedades antiinflamatorias ha sido útil para definir las acciones biológicas del receptor H4 (Thurmond et al., 2008).
Aspectos químicos.
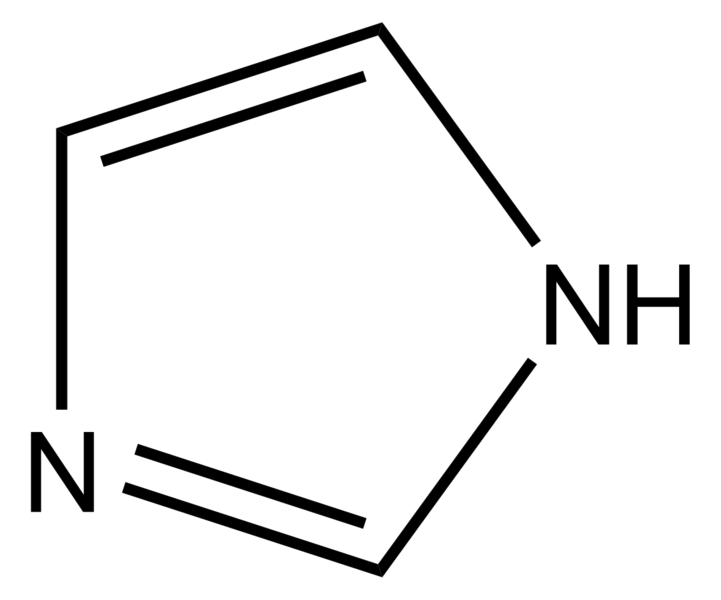
La histamina es una molécula hidrófila que consiste en un anillo imidazol y un grupo amino conectado por dos grupos metileno. Su forma farmacológicamente activa es un tautómero de Nγ-H monocatiónico, que es la forma cargada de la especie, señalada en la figura 32-1 (Ganellin y Parsons, 1982). Los receptores H3 y H4 tienen una afinidad mucho mayor por la histamina que los receptores H1 y H2 y es posible que la activación de los cuatro receptores histamínicos sea diferente por los análogos de la histamina (Venable y Thurmond, 2006) (fig. 32-1 y cuadro 32-1). Después del descubrimiento del receptor H4 se revaloraron las especificidades de los análogos de histamina. De este modo, la 4-metilhistamina y el dimaprit, clasificados originalmente como receptores H2 (Black et al., 1972), fueron considerados agonistas plenos de H4 con afinidades ~100 veces mayores, por el receptor H4.
Diversos agonistas de H3 también lo son, aunque en forma más débil del receptor H4 (Lim et al., 2005; Venable y Thurmond, 2006).


La Clorfeniramina la conocemos mejor por su nombre Clorfenamina.
Distribución y biosíntesis de la histamina
Distribución. La histamina está distribuida ampliamente (aunque de manera desigual) en el reino animal y aparece en muchos venenos, bacterias y plantas. Prácticamente todos los tejidos de mamíferos la contienen en cantidades que varían <1 μg hasta >100 μg/g. Las concentraciones en el plasma y otros líquidos corporales por lo común son muy pequeñas, pero el líquido cefalorraquídeo de humanos (LCR) la contiene en cantidades importantes. El sitio predominante de almacenamiento de la histamina en casi todos los tejidos son las células cebadas; la concentración de histamina es particularmente alta en tejidos que contienen un gran número de dichas células, como la piel, la mucosa bronquial y la mucosa intestinal.
Síntesis, almacenamiento y metabolismo. La histamina se forma por la descarboxilación del aminoácido histidina, por acción de la enzima l-histidina descarboxilasa (fig. 32-2) presente en todos los tejidos de mamíferos que contienen histamina. El principal sitio de almacenamiento de tal sustancia en casi todos los tejidos son las células cebadas; y en la sangre, los basófilos. Las células en cuestión sintetizan y almacenan la histamina, en los gránulos secretores.


En el gránulo secretor con pH de ~5.5 la histamina posee carga positiva y establece complejos iónicos con grupos ácidos de carga negativa en otros constituyentes de los gránulos, principalmente proteasas y heparina o proteoglucanos como sulfato de condroitina. Es lento el recambio de histamina en los gránulos secretores y tejidos en que abundan las células cebadas, y si se agotan las reservas de histamina en ellas, puede ser necesario que transcurran semanas para que la concentración vuelva a valores normales. Además de las células cebadas otros sitios en donde forma histamina son la epidermis, la mucosa gástrica, neuronas en el interior del SNC y células en tejidos que se regeneran o que crecen rápidamente, entre otros. El recambio o reposición es rápida en dichos sitios fuera de las células cebadas, porque la histamina es liberada de manera continua y no es almacenada. Los sitios mencionados contribuyen en grado significativo a la excreción diaria de los metabolitos de dicha amina en la orina. La l-histidina descarboxilasa es una enzima inducible, razón por la cual la capacidad histaminógena de dichos sitios está sujeta a regulación.
La histamina ingerida o formada por bacterias en el tubo digestivo no contribuye a las reservas corporales sino que es metabolizada rápido, y los metabolitos son eliminados en la orina.
El metabolismo de la histamina en los seres humanos sigue dos grandes vías (fig. 32-2): la más importante es la metilación del anillo hasta formar N-metilhistamina, catalizada por la histamina N-metiltransferasa, distribuida ampliamente. Después, gran parte de la N-metilhistamina es transformada en ácido N-metilimidazolacético por la monoaminooxidasa (MAO), reacción que puede ser bloqueada por los inhibidores de la MAO . Como otra posibilidad, la histamina puede ser sometida a desaminación oxidativa catalizada más bien por la enzima inespecífica diaminooxidasa, lo que provoca la formación del ácido imidazolacético
que es transformado en ribósido del ácido imidazolacético. Los metabolitos en cuestión poseen escasa o nula actividad y son excretados por la orina.
La medición de la N-metilhistamina en la orina permite contar con un índice más fiable de la producción de la amina, que la evaluación de la propia histamina. Las concentraciones artificialmente elevadas de la histamina en orina provienen de bacterias en las vías genitourinarias que pueden descarboxilar la histidina.
Además, al parecer se altera el metabolismo de la histamina en sujetos con mastocitosis, de tal forma que la cuantificación de los metabolitos de histamina es un indicador diagnóstico más sensible que la propia histamina.

