2013
USP 36 – Farmacopea de los estados unidos de américa
NF 31- Formulario nacional
788 PARTÍCULAS EN INYECTABLES
| Cambio de la redacción: |
Este capítulo general está armonizado con los textos correspondientes de la farmacopea europea y/o la farmacopea japonesa. Estas farmacopeas se han comprometido a no realizar ningún cambio unilateral a este capítulo armonizado.
Las partes del texto de este capítulo general que son texto USP nacional y , por lo tanto, no forman parte del texto armonizado, están indicadas con símbolos (*-) para especificar este hecho.
Las partículas en inyectables e infusiones parenterales consisten en partículas no disueltas móviles extrañas que no son burbujas gaseosas, accidentalmente presentes en las soluciones.
- Según se indica en Inyectables (1), las soluciones para inyección que se administran por vía intramuscular o subcutánea deben cumplir con los requisitos de Partículas en inyectables (788). Este requisito ha sido pospuesto indefinidamente para productos de uso veterinario. Las preparaciones parenterales envasadas y etiquetadas exclusivamente para usar como soluciones de irrigación están exentas de los requisitos de Partículas inyectables (788). Los productos parenterales cuyo etiquetado especifica el uso de un filtro final antes de la administración están exentos de los requisitos de partículas en inyectables (788), siempre que se disponga de datos científicos que justifiquen dicha exención. –
Para la determinación de las partículas, se especifican a continuación dos procedimientos, el
Método 1 ( Prueba de conteo de partículas por obstrucción de luz) y el
Método 2 (Prueba de conteo Microscópico de partículas).
Cuando se examinan inyecciones e infusiones parenterales para detectar la presencia de partículas subvisibles, es preferible aplicar el Método 1. Sin embargo, puede ser necesario analizar algunas preparaciones mediantes la Prueba de Conteo de Partículas por Obstrucción de luz seguida de la prueba de conteo microscópico de partículas para determinar en forma concluyente si cumple con los requisitos.
No todas las preparaciones parenterales se pueden examinar con uno de estos métodos o con ambos para detectar la presencia de partículas subvisibles. Cuando el Método 1 no es aplicables, p.ej., en el caso de preparaciones que presenten una transparencia reducida o una viscosidad aumentada, se debe llevar a cabo la prueba según el Método 2. Las emulsiones, coloides y preparaciones liposomales son algunos ejemplos. De la misma manera, los productos que producen burbujas de aire u otro gas cuando se aspiran dentro del sensor también pueden requerir un análisis de conteo microscópico de partículas. Si la viscosidad de la preparación a analizar es lo suficientemente alta como para impedir el análisis por cualquiera de los dos métodos, se puede realizar una dilución cuantitativa con un diluyente adecuado para reducir su viscosidad, según sea necesario, y así permitir la realización del análisis.
Los resultados obtenidos al analizar una unidad discreta o un grupo de unidades para detectar la presencia de partículas no pueden extrapolarse con certeza a otras unidades que no fueron examinadas. Por lo tanto, si se desean realizar inferencias válidas a partir de los datos observados para caracterizar el nivel de partículas en un grupo grande de unidades, se deben desarrollar planes de muestreo estadísticamente confiables.
(*-) A los fines de este capítulo, preparación parenteral de pequeño volumen es sinónimo de inyección de pequeño volumen, y preparación parenteral de gran volumen es sinónimo de inyección de gran volumen
| Cambio de la redacción: |
MÉTODO 1
PRUEBA DE CONTEO DE PARTÍCULAS POR OBSTRUCCIÓN DE LUZ
Usar un aparato adecuado basado en el principio de bloqueo de la luz que permita una determinación automática del tamaño de las partículas y el número de partículas según el tamaño. La definición de agua exenta de partículas se proporciona en Especificaciones de Reactivos – Reactivos Indicadores y Soluciones.
Calibrar el aparato usando dispersiones que contengan partículas esféricas de tamaños conocidos entre 10 um y 25 um. Dispersar el estandar de particulas en agua exenta de partículas. Se deben tomar las precauciones necesarias para evitar el agregado de partículas durante la dispersión. •La aptitud del sistema puede verificarse usando el ER Partículas para Canteo USP•,
Precauciones Generales
Llevar a cabo la prueba en condiciones que limiten la presencia de partículas, preferentemente en un gabinete con flujo de aire laminar.
Lavar muy cuidadosamente el material de vidrio y equipo de filtración usados, excepto los filtros de membrana, con una solución de detergente tibia, y enjuagar con cantidades abundantes de agua para eliminar todo rastro de detergente. Inmediatamente antes de usar, enjuagar el equipo desde arriba hacia abajo, por afuera y luego por dentro, con agua exenta de partículas.
Procurar no introducir burbujas de aire en la preparación a analizar, especialmente cuando se transfieren porciones de la preparación al recipiente en el cual se llevará a cabo la determinación.
Para verificar que el ambiente es adecuado para la prueba, que el material de vidrio se ha limpiado correctamente y que el agua a usar se encuentra exenta de partículas, llevar a cabo la siguiente prueba: determinar la presencia de partículas en cinco muestras de agua exenta de partículas de 5 mL cada una, según el método que se describe más adelante. Si el número de partículas con un tamaño igual o mayor de 10 um excede de 25 para la muestra combinada de 25 mL, las precauciones tomadas para la prueba no son suficientes. Se deben repetir las etapas preparatorias hasta que el ambiente, material de vidrio y agua sean adecuados para la prueba.
Método
Mezclar el contenido de la muestra invirtiendo el envase lentamente 20 veces sucesivas. Si fuera necesario, quitar cuidadosamente el cierre de sellado. Limpiar la superficie exterior de la apertura del envase empleando un chorro de agua exenta de partículas y quitar el cierre, evitando la contaminación del contenido. Eliminar las burbujas gaseosas mediante las medidas apropiadas tales como dejar en reposo durante 2 minutos o someter a ultrasonido.
Para preparaciones parenterales de gran volumen, se analizan unidades individuales. Para preparaciones parenterales de pequeño volumen de menos de 25 mL, combinar el contenido de 10 o más unidades en un recipiente limpio para obtener un volumen de no menos de 25 mL, la solución de prueba puede prepararse mezclando el contenido de un número adecuado de viales y diluyéndolo hasta 25 mL con 09u0 exenta de partículas o con un disolvente exento de partículas adecuado cuando el agua exenta de partículas no es adecuada. Las preparaciones parenterales de pequeño volumen con un volumen de 25 mL o más pueden analizarse individualmente.
Reconstituir los polvos para uso parenteral con agua exenta de partículas o con un disolvente exento de partículas apropiado cuando el agua exenta de partículas no es adecuada.
(-) “En el caso de envases a granel para farmacias para uso parenteral etiquetados con la leyenda “No Destinado para Infusión Directa”, proceder según se indica para preparaciones parenterales de pequeño volumen cuando el volumen sea 25 mL o más. Calcular el resultado de la prueba en una porción que sea equivalente a la dosis máxima prevista en el etiquetado. Por ejemplo, si el volumen total del envase a granel es 100 mL y el volumen de dosis máxima es 10 mL, entonces el conteo promedio de partículas por mL se multiplicaría por 10 para obtener el resultado de prueba basándose en la dosis máxima de 10 mL. [NOTA—Para los cálculos de los resultados de la prueba, considerar esta porción de dosis máxima equivalente al contenido de un envase lleno.] Los productos envasados con compartimentos duales diseñados para contener un producto farmacéutico y un disolvente deben ser preparados y analizados según se indica para preparaciones parenterales de gran volumen o preparaciones parenterales de pequeño volumen, dependiendo del volumen del envase. Mezclar cada unidad según se indica en el etiquetado, activando y agitando para asegurar el mezclado minucioso de los componentes individuales y la disolución del medicamento (-)USP36
El número de muestras de prueba debe ser suficiente para proporcionar una evaluación estadísticamente válida. Para preparaciones parenterales de gran volumen o de pequeño volumen con un volumen de 25 mL o más, se pueden analizar menos de 10 unidades, empleando un plan de muestreo adecuado. Tomar cuatro porciones, de no menos de 5 mL cada una, y contar el número de partículas iguales o mayores de 10 um y 25 um. No tomar en cuenta el resultado obtenido para la primera porción y calcular el número medio de partículas para la preparación a examinar.
Evaluación
Para preparaciones suministradas en envases con un volumen nominal de más de 100 mL, aplicar los criterios de la Prueba 1.A
Para preparaciones suministradas en envases con un volumen nominal de menos de 100 mL, aplicar los criterios de la Prueba 1.B.
Para preparaciones suministradas en envases con un volumen nominal de 100 mL, aplicar los criterios de la Prueba 1.B. [NOTA-La Farmacopea Japonesa usa la Prueba 2.A.]
Si el número promedio de partículas excede los límites, analizar la preparación mediante la Prueba de Conteo Microscópico de Partículas.
Prueba 1.A (Soluciones para infusión parenteral o soluciones para inyección suministradas en envases con un contenido nominal de más de 100 mL)—La preparación cumple con la prueba si el número promedio de partículas presentes en las unidades analizadas no excede de 25 partículas iguales o mayores de 10 um por mL y no excede de 3 partículas iguales o mayores de 25 um por mL.
Prueba 1.B (Soluciones para infusión parenteral o soluciones para inyección suministradas en envases con un contenido nominal de menos de 100 mL)—La preparación cumple con la prueba si el número promedio de partículas presentes en las unidades analizadas no excede de 600 partículas iguales o mayores de 10 pm por envase y no excede de 600 partículas iguales o mayores de 25 um por envase.
MÉTODO 2
PRUEBA DE CONTEO MICROSCÓPICO DE PARTÍCULAS
Usar un microscopio binocular adecuado, un dispositivo de filtración para retener partículas y un filtro de membrana para el análisis.
Ajustar el microscopio con aumentos de 100x ± 10x y equiparlo con un micrómetro ocular calibrado con un micrómetro objetivo, una platina mecánica capaz de sostener y recorrer toda la superficie de filtración del filtro de membrana y dos iluminadores adecuados para proporcionar iluminación episcópica además de la iluminación oblicua. El micrómetro ocular es una retícula circular para la medición del diámetro de partículas (ver la Figura 1)
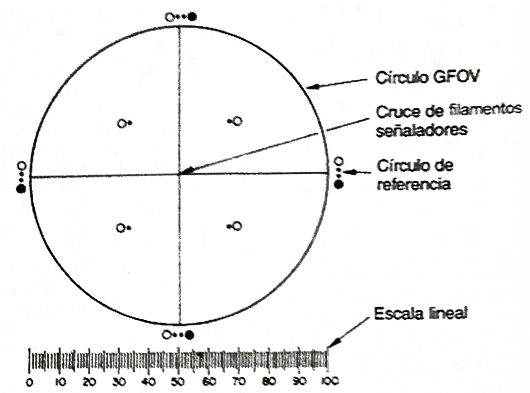
Fig. 1. Retícula circular para la medición del diámetro de partículas. El circulo grande que esta dividido por filamentos en cuadrantes se denomina campo reticular (GFOV, por sus siglas en inglés). Los círculos transparentes y de color negro, con diámetros de 10 um y 25 um en 100x, se proporcionan como elementos de comparación para clasificar las partículas por tamaño.
y consiste en un círculo grande que tiene filamentos señala-dores que lo dividen en cuadrantes, círculos de referencia transparentes y de color negro, con diámetros de 10 um y 25 um en aumentos de 100x, y una escala lineal con graduaciones en incrementos de 10 um. Calibrar empleando un micrómetro de platina, certificado por una institución de normalización nacional o internacional. Un error relativo de la escala lineal de la retícula dentro de ±2% es aceptable. El círculo grande se denomina campo reticular. Se requieren dos iluminadores. Uno es un iluminador episcópico interno de campo brillante, el otro es un auxiliar externo de foco regulable para dar iluminación oblicua reflejada en un ángulo de incidencia de 10º – 20º . El dispositivo de filtración para retener las partículas consiste en un soporte de filtro, de vidrio u otro material adecuado, provisto de una fuente de vacío y un filtro de membrana adecuado. El filtro de membrana tiene un tamaño adecuado, de color negro o gris oscuro, reticulado o no y con un tamaño nominal de poro de 1,0 um o menor.
Precauciones Generales
Llevar a cabo la prueba en condiciones que limiten la presencia de partículas, preferentemente en un gabinete con flujo de aire laminar. Lavar muy cuidadosamente el material de vidrio y de ensamblaje para filtración usados, excepto los filtros de membrana, con una solución de detergente tibia, y enjuagar con cantidades abundantes de agua para eliminar todo rastro de detergente. Inmediatamente antes de usar, enjuagar ambos lados del filtro de membrana y el equipo desde arriba hacia abajo, por afuera y luego por dentro, con agua exenta de ,partículas. Para verificar que el ambiente es adecuado para la prueba, que el material de vidrio y el filtro de membrana se han limpiado correctamente y que el agua a usar se encuentra exenta de partículas, llevar a cabo la siguiente prueba: determinar la presencia de partículas en SO mi_ de agua exenta de partículas, según el método que se describe más adelante. Si más de 20 partículas con un tamaño igual o mayor de 10 pm o si más de cinco partículas con un tamaño igual o mayor de 25 jim están presentes dentro del área de filtración, las precauciones tomadas para la prueba no son suficientes. Se deben repetir las etapas preparatorias hasta que el ambiente, material de vidrio, filtro de membrana y agua sean adecuados para la prueba.
Método
Mezclar el contenido de las muestras invirtiendo el envase lentamente 20 veces sucesivas. Si fuera necesario, quitar cuidadosamente el cierre de sellado. Limpiar la superficie exterior de la apertura del envase empleando un chorro de agua exenta de partículas y quitar el cierre, evitando la contaminación de contenido.
Para preparaciones parenterales de gran volumen, se analizan unidades individuales, Para preparaciones parenterales de pequeño volumen de menos de 25 mL, combinar el contenido de 10 o más unidades en un recipiente limpio; la solución de prueba puede prepararse mezclando el contenido de un número adecuado de viales y diluyéndolo hasta 25 mL con agua exenta de partículas o con un disolvente exento de partículas apropiado cuando el agua exenta de partículas no es adecuada. Las preparaciones parenterales de pequeño volumen con un volumen de 25 mL o más pueden analizarse individualmente.
Reconstituir los polvos para uso parenteral con agua exenta de partículas o con un disolvente exento de partículas adecuado cuando el agua exenta de partículas no es partículas as adecuada.
El número de muestras de prueba debe ser suficiente para proporcionar una evaluación estadísticamente válida . Para preparaciones parenterales de gran volumen o de pequeño volumen con un volumen de 25 mL o más, se pueden analizar menos de 10 unidades, empleando un plan de muestreo adecuado.
Humedecer con varios mL de agua exenta de partículas el interior del soporte de filtro provisto con el filtro de membrana. Transferir al embudo de filtración el volumen total de una solución combinada o una unidad individual y aplicar vacío. Si fuera necesario, agregar gradualmente porciones de la solución hasta filtrar todo el volumen. Después de la última adición de solución, empezar a enjuagar las paredes internas del soporte de filtro empleando un chorro de agua exento de partículas. Mantener el vacío hasta que la superficie del filtro de membrana se encuentre exenta de líquidos.
Colocar el filtro de membrana en una placa de Petri y dejarlo secar al aire con la tapa ligeramente abierta. Después de que el filtro de membrana se haya secado, colocar la placa de Petri en la platina del microscopio, recorrer todo el filtro de membrana bajo la luz reflejada por un dispositivo de iluminación y contar el número de partículas mayores o iguales a 10 um y el número de partículas mayores o iguales a 25 um. Como alternativa, se permite el conteo parcial del filtro de membrana y la determinación de! conteo total del filtro por cálculos. Calcular el número medio de partículas para la preparación que se va a analizar. El proceso de medición del tamaño de partículas usando la retícula circular se lleva a cabo estimando el diámetro equivalente de la partícula en comparación con los círculos de referencia de 10 um 25 um de la retícula. De esta forma, no se mueven las partículas de sus lugares originales dentro del campo reticular y no se superponen en los círculos de referencia para la comparación El diámetro interno de los círculos de referencia transparentes de la retícula se usa para medir las partículas blancas y transparentes, mientras que el diámetro externo de los círculos de referencia negro opaco de la retícula se usa para medir el tamaño de las partículas oscuras.
Cuando se realiza la Prueba de Conteo Microscópico ,Partículas, no se debe intentar la medición o el conteo de materiales amorfos, semilíquidos o morfológicamente indeferenciados y que tengan la apariencia de una mancha o decoloración en el filtro de membrana. Estos materiales muestran poco o ningún relieve y presentan un aspecto gelatinoso o similar al de una película. El tales casos, puede facilitarse la interpretación del conteo analizando una muestra de la solución mediante la Prueba de Conteo de Partículas por Obstrucción de Luz.
Evaluación.
Para preparaciones suministradas en envases con un volumen nominal de más de 100 mL, aplicar los criterios de la Prueba 2.A.
Para preparaciones suministradas en envases con un volumen nominal de menos de 100 ml, aplicar los criterios de la prueba 2.B
Para preparaciones suministradas en envases con un volumen nominal de 100 mL, aplicar los criterios de la Prueba 2.B [NOTA-La Farmacopea Japonesa usa la Prueba 2.A.]
Prueba 1.A (Soluciones para infusión parenteral o soluciones para inyección suministradas en envases con un contenido nominal de más de 100 mL)—La preparación cumple con la prueba si el número promedio de partículas presentes en las unidades analizadas no excede de 12 partículas iguales o mayores de 10 um por mL y no excede de 2 partículas iguales o mayores de 25 um por mL.
Prueba 1.B (Soluciones para infusión parenteral o soluciones para inyección suministradas en envases con un contenido nominal de menos de 100 mL)—La preparación cumple con la prueba si el número promedio de partículas presentes en las unidades analizadas no excede de 3000 partículas iguales o mayores de 10 pm por envase y no excede de 300 partículas iguales o mayores de 25 um por envase.
