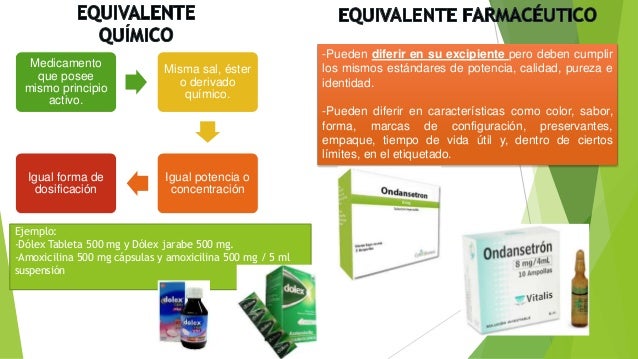
Alternativas farmacéuticas (OMS): son aquellos productos que contienen el/los mismo(s) principio(s) activo(s) pero en diferentes formas de dosificación (comprimidos, cápsulas, entre otros), potencia, y/o forma química (ej. Diferentes sales o ésteres).
Las alternativas farmacéuticas entregan la misma molécula por la misma vía de administración pero no son equivalentes farmacéuticos. Pueden o no ser equivalentes terapéuticos con el producto comparador.

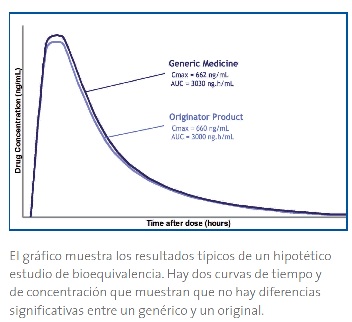
Biodisponibilidad: Es la cantidad de un principio activo liberada desde una forma farmacéutica, que llega a la circulación sistémica y la velocidad con que esto ocurre. Si se comparan las biodisponibilidades de dos productos, se denomina biodisponibilidad relativa.

Bioequivalencia (BE): Equivalentes o alternativas farmacéuticas para los cuales sus biodisponibilidades en términos de velocidad (Cmax y tmax) y extensión de la absorción (AUC), luego de la administración de la misma dosis molar bajo las mismas condiciones son similares en tal grado que sus efectos son esencialmente los mismos (definición OMS, 2015).

Biolote (del inglés biobatch): Lote del producto formulado con el propósito de realizar una evaluación farmacocinética en un estudio de bioequivalencia/bioexención. Las muestras del producto prueba deben ser obtenidas de un lote escala 1:10 o un lote industrial de 100,000 unidades, el que sea mayor.
Debe cumplir con la norma oficial de Buenas Prácticas de Manufactura.
Eficacia: Capacidad de un medicamento o producto farmacéutico para producir los efectos terapéuticos esperados, determinada por métodos farmacodinámicos y estudios clínicos realizados en seres humanos.
Equivalentes farmacéuticos: Productos farmacéuticos que contienen idénticas cantidades de los mismos principios activos o sus mismas sales o ésteres, presentados en idéntica forma farmacéutica y vía de administración y que cumplen con las mismas o comparables especificaciones de calidad, pero que no necesariamente contienen los mismos excipientes. La equivalencia farmacéutica no implica necesariamente equivalencia terapéutica.
Equivalentes terapéuticos: Equivalentes o alternativas farmacéuticas que cumplen con las mismas o comparables especificaciones de calidad y que al ser administrados bajo las mismas condiciones para la misma indicación, sus efectos, con respecto a eficacia y seguridad, son esencialmente los mismos, todo ello determinado por estudios apropiados (estudio comparativo de biodisponibilidad, farmacodinámico, clínico o in vitro). Tales productos deben ser fabricados bajo buenas prácticas de manufactura y un control de proceso que permita su reproducibilidad en el tiempo.

DCI: denominación común internacional.
Excipiente: Cualquier materia prima destinada a la farmacotecnia de la forma farmacéutica, utilizada en la manufactura de los productos farmacéuticos.
Estudio cinético de disolución comparativo: Prueba in vitro que, mediante condiciones experimentales científicamente definidas, permite establecer la comparación del perfil cinético de disolución de un principio activo desde una forma farmacéutica sólida respecto de un referente. Se considera discriminativo cuando este ensayo permite diferenciar la liberación del principio activo como consecuencia de la formulación.

Producto de fuente múltiple: son productos equivalentes farmacéuticos o alternativas farmacéuticas que pueden o no ser equivalentes terapéuticos. Los productos farmacéuticos de fuentes múltiples que son equivalentes terapéuticos son intercambiables con el producto de referencia.
Producto de referencia o comparador (PR): Producto determinado por la autoridad sanitaria como tal, respecto del cual se compara otro que requiere evaluación de su equivalencia terapéutica.




